بخش سوم: هموستاز محیط داخلی
فیزیولوژی پیشرفته کلیه و گوارش برای پرستاران
مقدمه: درک عمیق فیزیولوژی انسان، سنگبنای عملکرد بالینی موثر در پرستاری، به ویژه در بخشهای مراقبت ویژه (ICU)، دیالیز و بخشهای داخلی-جراحی است. این گزارش جامع، با رویکردی تخصصی و آموزشی، به تشریح دقیق مکانیسمهای کلیوی و گوارشی دخیل در هموستاز میپردازد و ابزارهای لازم برای تصمیمگیری بالینی را در اختیار تیم پرستاری قرار میدهد.
۱. مقدمه: مفهوم هموستاز و نقش حیاتی پرستاری در مراقبتهای ویژه
مفهوم «محیط داخلی» (Milieu Intérieur) که نخستین بار توسط کلود برنارد مطرح شد، به مایع خارج سلولی اشاره دارد که سلولهای بدن در آن غوطهور هستند. حفظ ثبات این محیط، یا هموستاز، وظیفه اصلی سیستمهای فیزیولوژیک بدن است. در این میان، کلیهها و دستگاه گوارش نقشهای محوری و مکمل یکدیگر را ایفا میکنند. کلیهها به عنوان فیلترهای هوشمند، حجم و ترکیب شیمیایی مایعات بدن را تنظیم میکنند، در حالی که دستگاه گوارش مسئول تأمین مواد مغذی و الکترولیتهای لازم برای این فرآیندها است.
برای دانشجویان پرستاری و پرستاران بالینی، گذار از دانش تئوری به کاربرد بالینی در این حوزه حیاتی است. تفسیر صحیح گازهای خون شریانی (ABG)، مدیریت دقیق مایع درمانی (Fluid Therapy)، درک مکانیسم اثر دیورتیکها در نارسایی قلبی و کلیوی، و شناخت عوارض ناشی از سوءجذب گوارشی، همگی نیازمند تسلط بر اصول فیزیولوژیک زیربنایی هستند.
۲. فیزیولوژی کلیه: فیلتراسیون، تغلیظ و تنظیم حجم
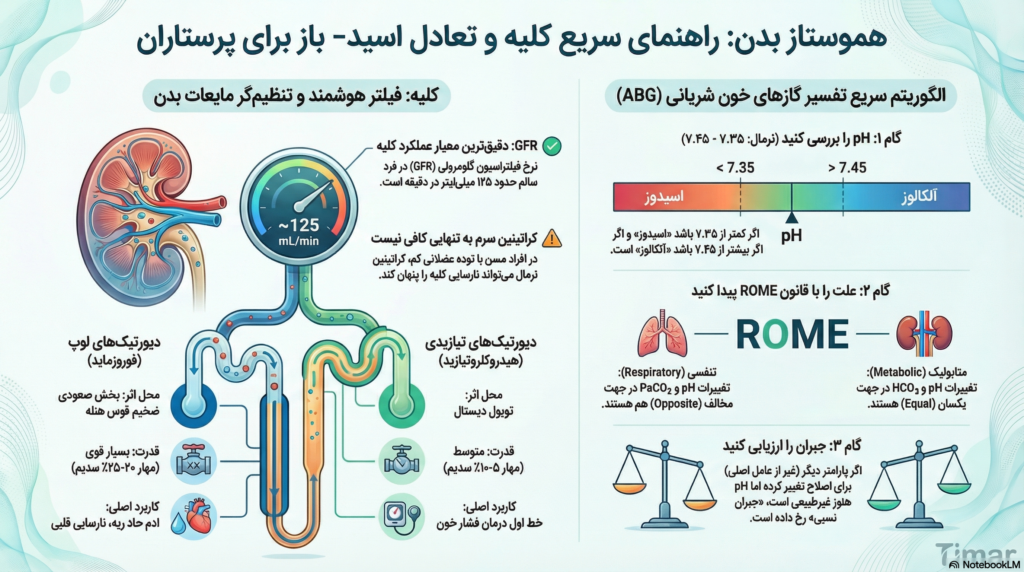
کلیهها با دریافت حدود ۲۰ تا ۲۵ درصد برونده قلبی، مسئولیت سنگین پاکسازی خون و تنظیم دقیق اسمولاریته پلاسما را بر عهده دارند. درک عملکرد کلیه با شناخت واحد عملکردی آن، نفرون، و فرآیندهای فیلتراسیون گلومرولی آغاز میشود.
۲.۱ نرخ فیلتراسیون گلومرولی (GFR) و کلیرانس کراتینین
۲.۱.۱ دینامیک فیلتراسیون گلومرولی (GFR)
نرخ فیلتراسیون گلومرولی (GFR) حجم مایعی است که در هر دقیقه از مویرگهای گلومرولی به داخل کپسول بومن فیلتر میشود. این شاخص، دقیقترین معیار برای ارزیابی عملکرد کلیه و تعداد نفرونهای فعال است. در یک فرد بالغ سالم، GFR نرمال حدود ۱۲۵ میلیلیتر در دقیقه یا ۱۸۰ لیتر در روز است.
تنظیم خودکار (Autoregulation): یکی از ویژگیهای حیاتی کلیه، توانایی آن در حفظ GFR ثابت علیرغم نوسانات فشار خون سیستمیک (بین ۸۰ تا ۱۸۰ میلیمتر جیوه) است. این امر از طریق پاسخ میوژنیک و فیدبک توبولوگلومرولی صورت میگیرد.
۲.۱.۲ کلیرانس کراتینین به عنوان شاخص بالینی
اگرچه GFR استاندارد طلایی است، اما اندازهگیری مستقیم آن دشوار است. در عمل بالینی، از کلیرانس کراتینین (CrCl) به عنوان تخمینی از GFR استفاده میشود.
پیامدهای پرستاری و تفسیر آزمایشگاهی:
- تأثیر توده عضلانی: سطح سرمی کراتینین به تنهایی شاخص دقیقی نیست. یک فرد مسن با توده عضلانی کم ممکن است کراتینین سرمی “نرمال” داشته باشد، در حالی که GFR او به شدت کاهش یافته است.
- مراحل نارسایی کلیه (CKD):
- مرحله ۱: GFR > 90 (آسیب کلیوی با عملکرد نرمال).
- مرحله ۳ (متوسط): GFR 30-59 (شروع عوارض متابولیک).
- مرحله ۵ (نارسایی کامل): GFR < 15 (نیاز به دیالیز یا پیوند).
۲.۲ مکانیسم تغلیظ ادرار: نقش حیاتی قوس هنله
توانایی کلیه در تولید ادرار تغلیظ شده (هایپراسموتیک) برای بقای انسان در شرایط کمآبی ضروری است. این عملکرد پیچیده در قوس هنله و از طریق سیستم «ضد جریان افزاینده» انجام میشود.
۲.۲.۱ آناتومی و عملکرد قوس هنله
قوس هنله ساختاری U شکل است که به عمق مدولای کلیه نفوذ میکند. بخش نزولی به آب نفوذپذیر است و باعث تغلیظ ادرار میشود. بخش صعودی ضخیم به آب نفوذناپذیر است و پمپهای فعال یونها را خارج میکنند تا مدولا شور شود.
۲.۲.۲ وازا رکتا (Vasa Recta): مبادلهگر ضد جریان
عروق خونی اطراف قوس هنله به عنوان «مبادلهگر ضد جریان» عمل میکنند و بدون از بین بردن گرادیان شوری مدولا، مواد مغذی را رسانده و آب بازجذب شده را بازمیگردانند.
نکته بالینی برای پرستاران: در نکروز توبولی حاد (ATN)، مکانیسم تغلیظ آسیب میبیند و ناتوانی در تغلیظ ادرار (ایزوستنوری) رخ میدهد.
۲.۳ دیورتیکها: مقایسه مکانیسم و کاربرد بالینی (لوپ در برابر تیازید)
درک تفاوتهای بنیادین بین دیورتیکهای لوپ (مانند فوروزماید) و تیازیدی (مانند هیدروکلروتیازید) برای پایش صحیح بیمار ضروری است.
| ویژگی | دیورتیکهای لوپ (فوروزماید/Lasix) | دیورتیکهای تیازیدی (هیدروکلروتیازید) |
|---|---|---|
| محل اثر در نفرون | بخش صعودی ضخیم قوس هنله | توبول دیستال پیچخورده (DCT) |
| مکانیسم مولکولی | مهار همانتقالدهنده Na-K-2Cl (NKCC2) | مهار همانتقالدهنده Na-Cl (NCC) |
| قدرت دیورتیک | بسیار قوی (High-ceiling) | متوسط |
| کاربرد اصلی | ادم حاد ریه، نارسایی قلبی (CHF)، نارسایی کلیوی | خط اول درمان فشار خون (Hypertension) |
| تأثیر بر کلسیم | افزایش دفع کلسیم (خطر هیپوکلسمی) | کاهش دفع کلسیم (خطر هیپرکلسمی) |
| عوارض جانبی خاص | اتوتوکسیسیتی (آسیب شنوایی) در تزریق سریع | افزایش قند خون، اسید اوریک و چربی خون |
۲.۳.۱ تحلیل مکانیسم و مراقبتهای پرستاری
چرا فوروزماید قویتر است؟ قوس هنله مسئول بازجذب درصد بالایی از سدیم است. بلوک کردن آن حجم عظیمی از آب و سدیم را به بخشهای انتهایی میفرستد که ظرفیت جذب ندارند.
پایش الکترولیتها: هر دو دسته دارویی باعث دفع پتاسیم میشوند (خطر هیپوکالمی). پرستار باید سطح پتاسیم سرم را به دقت پایش کند.
۲.۴ تنظیم سدیم و پتاسیم: نقش آلدوسترون
تنظیم نهایی حجم خون و غلظت پتاسیم تحت کنترل هورمون آلدوسترون صورت میگیرد.
- مکانیسم سلولی: آلدوسترون بازجذب سدیم (و آب) و دفع پتاسیم را در توبولهای جمعکننده افزایش میدهد.
- دلالتهای بالینی: مهارکنندگان آلدوسترون (اسپیرونولاکتون) «دیورتیکهای نگهدارنده پتاسیم» هستند. در نارسایی آدرنال (بیماری آدیسون)، فقدان آلدوسترون منجر به هیپوناترمی و هیپرکالمی میشود.
۳. تعادل اسید و باز: تفسیر و مداخله
حفظ pH خون شریانی در محدوده ۷.۳۵ تا ۷.۴۵ حیاتی است.
۳.۱ سیستمهای بافری بدن
بدن سه خط دفاعی دارد: بافرهای شیمیایی (فوری)، تنظیم تنفسی (دقایق) و تنظیم کلیوی (ساعتها تا روزها).
۳.۲ تفسیر گازهای خون (ABG) و الگوریتم پرستاری
۳.۲.۱ الگوریتم سریع تفسیر ABG برای پرستاران
- بررسی pH: کمتر از ۷.۳۵ (اسیدوز) یا بیشتر از ۷.۴۵ (آلکالوز).
- بررسی PaCO2 (شاخص تنفسی): قانون R.O. (Respiratory Opposite) – اگر تغییرات pH و PaCO2 خلاف جهت هم باشند، مشکل تنفسی است.
- بررسی HCO3 (شاخص متابولیک): قانون M.E. (Metabolic Equal) – اگر تغییرات pH و HCO3 همجهت باشند، مشکل متابولیک است.
- بررسی جبران (Compensation): آیا پارامتر دیگر برای اصلاح pH تغییر کرده است؟
۳.۳ چهار اختلال اصلی اسید و باز با مثالهای عددی
- اسیدوز تنفسی: ناتوانی ریه در دفع CO2 (مانند COPD). pH پایین، PaCO2 بالا.
- آلکالوز تنفسی: دفع بیش از حد CO2 (مانند اضطراب). pH بالا، PaCO2 پایین.
- اسیدوز متابولیک: تولید اسید یا دفع بیکربنات (مانند DKA، اسهال). pH پایین، HCO3 پایین.
- آلکالوز متابولیک: از دست دادن اسید یا تجمع باز (مانند استفراغ). pH بالا، HCO3 بالا.
۴. فیزیولوژی گوارش: تنظیم ترشح، هضم چربی و جذب ویتامین
۴.۱ کنترل ترشح اسید معده: سمفونی عصبی و هورمونی
۴.۱.۱ فازهای ترشح اسید
شامل فاز سفالیک (دیدن/بوییدن غذا)، فاز گاستریک (ورود غذا به معده) و فاز رودهای است.
۴.۱.۲ سه پیامرسان اصلی سلول پاریتال
استیلکولین، گاسترین و هیستامین ترشح اسید را تحریک میکنند که در نهایت باعث فعال شدن پمپ پروتون میشوند.
- داروهای PPI (امپرازول): مهارکننده مستقیم و قوی پمپ پروتون.
- داروهای H2-Blocker (رانیتیدین): مهارکننده گیرنده هیستامین.
۴.۲ نقش صفرا در هضم چربی: امولسیفیکاسیون و میسلسازی
صفرا حاوی نمکهای صفراوی است که مانند شوینده عمل میکنند.
- امولسیفیکاسیون: شکستن قطرات بزرگ چربی به قطرات میکروسکوپی.
- تشکیل میسل: انتقال چربیها و ویتامینهای محلول در چربی به سطح روده برای جذب.
- نکته پرستاری: اختلال در چرخه انتروهپاتیک (بیماری کرون) منجر به سوءجذب چربی و کمبود ویتامینهای محلول در چربی میشود.
۴.۳ جذب ویتامین B12 و فاکتور داخلی (Intrinsic Factor)
۴.۳.۱ مسیر جذب B12
ویتامین B12 باید به فاکتور داخلی (IF) ترشح شده از معده متصل شود تا در ایلئوم ترمینال جذب گردد.
۴.۳.۲ کمخونی پرنیشیوز (Pernicious Anemia)
در صورت تخریب سلولهای پاریتال یا گاسترکتومی، فاکتور داخلی تولید نمیشود و B12 جذب نمیگردد. درمان شامل تزریق عضلانی B12 است.
۵. نتیجهگیری و تلفیق مفاهیم
در این بخش، ارتباط تنگاتنگ بین سیستمهای کلیوی و گوارشی در حفظ محیط داخلی بدن به وضوح نشان داده شد. یک پرستار متخصص باید بداند که استفراغ شدید منجر به آلکالوز متابولیک و هیپوکالمی میشود که عملکرد کلیه را تحت تأثیر قرار میدهد. تسلط بر الگوریتم تفسیر ABG و شناخت فیزیولوژی جذب مواد مغذی، پرستار را از یک مجری دستورات به یک تحلیلگر بالینی و عضو کلیدی تیم درمان تبدیل میکند.